Zajímavé vlastnosti vody
trocha fyziky
Voda je pro život důležitá a ještě důležitější je pro potápěče. Pro svoji důležitost a všeobecný výskyt je považována za nejběžnější kapalinu. Její vlastnosti však běžné nejsou.
Voda H2O (chemicky oxidan, nesprávně též dihydrogenmonooxid nebo kyselina hydroxylová3) je chemická sloučenina vodíku a kyslíku. Vzniká prudkým až explozivním slučováním (hořením) vodíku s kyslíkem za vývinu velkého množství tepla (exotermní reakce) nebo jako vedlejší produkt (vedle solí) neutralizace kyselin zásadami.
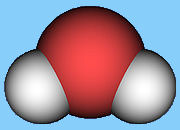 Mimořádné chemické a fyzikální vlastnosti vody jsou důsledkem geometrie její molekuly. Ta je asymetrická - atomy vodíku jsou na kyslík navázány v úhlu 104.45° (viz. obrázek). Díky tomu je molekula výrazně polarizovaná. Mezi molekulami vody vznikají vodíkové vazby (můstky)1, které také ovlivňují mnoho jejích vlastností.
Mimořádné chemické a fyzikální vlastnosti vody jsou důsledkem geometrie její molekuly. Ta je asymetrická - atomy vodíku jsou na kyslík navázány v úhlu 104.45° (viz. obrázek). Díky tomu je molekula výrazně polarizovaná. Mezi molekulami vody vznikají vodíkové vazby (můstky)1, které také ovlivňují mnoho jejích vlastností.
O té nejznámější podivnosti se snad každý potápěč učil v základním kurzu - voda má maximální hustotu při 3.984 °C. Hustota kapalné vody je tedy vetší, než hustota pevné vody (ledu). Zahříváním ze 4 °C se voda rozpíná (to je normální), ochlazování se však také rozpíná (to je abnormální). Tomu říkáme anomálie vody.
Teplota varu vodu - tedy přechodu ze skupenství kapalného do plynného je 100 °C, teplota tuhnutí vody - tedy přechodu ze skupenství kapalného do pevného je 0 °C, to víme již ze základní školy.
Podívejme se na skupenské chování vody detailněji. Kritická teplota vody K2 je 374.15 °C. Mezi touto teplotou a teplotou varu se vyskytuje jako vodní pára nebo přehřátá kapalina. Stabilní kapalinou je voda mezi 100 °C a 0 °C. V trojném bodu vody (0.01 °C při tlaku 0.61 kPa) mohou existovat v rovnováze všechna tři skupenství. Pod bodem tuhnutí se vyskytuje jako led nebo podchlazená voda. Podchlazená voda při sebemenším podnětu rychle krystalizuje.
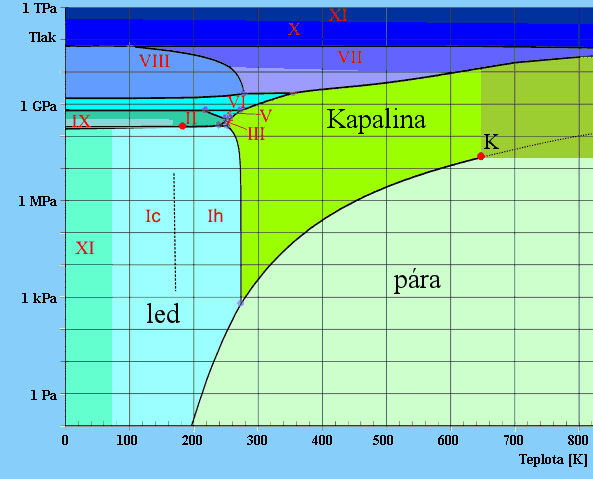
Za normálního tlaku se ani ultračistou vodu ve větším množství nepodaří podchladit pod bod -38 °C (homogenní nukleace). Zde vzniká buď krystalický led Ih (šesterečná krystalická struktura - ikosaedrální) nebo nekrystalická amorfní voda - "sklo". Pokud vodu umístíme do nanopórů, dá se experimentálně zjistit, že dalším ochlazováním hustota vody stále hlesá do -63°C, zde se křivka opět obrátí a hustota zase roste. I těchto miniaturních pórech vydrží voda kapalná jen do -120 °C, pak krystalizuje do kubické mřížky Ic. Kromě těchto základních krystalických struktur vody existují další, označené římskými číslicemi II až XI, lišící se tvarem krystalu.
Anomálie vody má zásadní význam pro přežití vodních živočichů po dobu zimy. Chladnější (a lehčí) voda u hladiny zmrzne dříve než u dna a vytvoří tak příkrov, který chrání život v tekuté vodě u dna. Rozpínání tuhé fáze v zimním období zase vede k erozi hornin.
Měrná tepelná kapacita (specifické teplo - 4217.8 J/kg.K) vody je třikrát větší, než u většiny ostatních látek. To způsobuje její poměrně velkou tepelnou setvačnost, které využíváme k transportu tepla třeba v ústředním topení. Díky velkému obsahu vody v tělesných tkáních to také pomáhá živočichům udržovat tělesnou teplotu. Zajímavé je, že toto specifické teplo dvakrát větší u kapalné vody než u ledu nebo páry.
Specifické skupenské teplo (333.7 J/g při tání a 2255.5 J/g při varu) má voda také neobvykle veliké (téměř jako stříbro). To například umožňuje teploktevným obratlovcům účinné ochlazování pocením.
Voda je zejména díky své malé molekule, polarizaci a vysoké dielektrické konstantě výborným rozpouštědlem, hlavně pro polární a iontové sloučeniny a soli.
Zajímavé je vysoké povrchové napětí vody (72.75 mJ/m2), jeho průběh při změně teploty nevykazuje úchylku, jež by měla být spojena s hustotní anomálií. Povrchové napětí ocení potápěči pro rozpouštění malých bublin plynu v krvi - viz článek TS.
Nejzvláštnější je, že vlastnosti vody, o kterých říkáme, že jsou abnormální či anomální, jsou zároveň podmínkou vzniku a udržení života, což považujeme za normální.
1 Vodíkové můstky: Protože atom vodíku má pouze jeden elektron, dojde při vytvoření vazby k elektronegativnímu prvku ke značnému odhalení atomového jádra. Vzniklý parciální kladný náboj na atomu vodíku může poutat nevazebné elektronové páry okolních molekul. Tato vazba je silnější než většina ostatních mezimolekulárních sil, ale je podstatně slabší (asi 10x) než iontová nebo kovalentní vazba. Vznik vodíkové vazby je možný pouze u velmi elektronegativních prvků, jako jsou fluor, kyslík a dusík. Jedině tyto tři prvky jsou schopné v dostatečné míře odčerpat elektronovou hustotu od atomu vodíku. Proto sloučeniny vodíku s fluorem, dusíkem a hlavně kyslíkem mají své zvláštnosti.
2 Kritická teplota: Teplota, nad níž již neexistuje za žádného tlaku kapalná fáze, nad touto teplotou zmizí rozhraní mezi plynem a kapalinou a látka se stane stejnorodou.
3 Na webu dhmo.org můžete sledovat kauzu, v níž se autoři snaží pomocí mnoha důkazů doložit postulát, že dihydrogenmonooxid je životu nebezpečná látka. A mnozí je berou zcela vážně.
